REACCIONES QUÍMICAS
Las reacciones químicas ocurren cuando se forman o rompen los enlaces químicos entre átomos. Las sustancias que intervienen en una reacción química se denominan reactivos (se encuentran generalmente del lado izquierdo de una ecuación química), y las sustancias producidas al final de la reacción se conocen como productos(generalmente se encuentran al lado derecho de la ecuación química). A menudo se dibuja una flecha entre los reactivos y los productos para indicar la dirección de la reacción química.Tipos de reacciones
Reacción de síntesis o adición
Las Reacciones de Combinación:
Las Reacciones de Combinación o Reacciones de Síntesis son aquellas en las que dos sustancias se unen para formar un único producto. En esta reacción los átomos de los reactivos se reagrupan para dar lugar el producto según la fórmula:
A + B → AB
donde A y B representan dos sustancias químicas cualesquiera.Ejemplos:Na2O + H2O → 2Na(OH)MgO + SO3 → MgSO42 Na + Cl2 → 2 NaClCl2 + H2 → 2HCl
En el caso de los metales, los mas activos son los metales alcalinos y metales alcalinos térreos.
En el caso de los no metales, los mas reactivos son algunos halogenos : Fl2 , Cl2 , Br2 ; además del oxígeno y el fósforo.
En el caso de los metales, los mas activos son los metales alcalinos y metales alcalinos térreos.
En el caso de los no metales, los mas reactivos son algunos halogenos : Fl2 , Cl2 , Br2 ; además del oxígeno y el fósforo.

Reacción de descomposición
Se le conoce “reacción de descomposición” a las reacciones en las cuales una sola sustancia se descompone/rompe, produciendo 2 o más sustancias distintas. Prácticamente puede considerarse lo contrario a la reacción de combinación. El material inicial debe ser un compuesto y las sustancias derivadas pueden ser compuestos o elementos. La fórmula general de estas reacciones es:
AB A + B
Generalmente las reacciones de descomposición:
• Descomposición Térmica
• Electrólisis
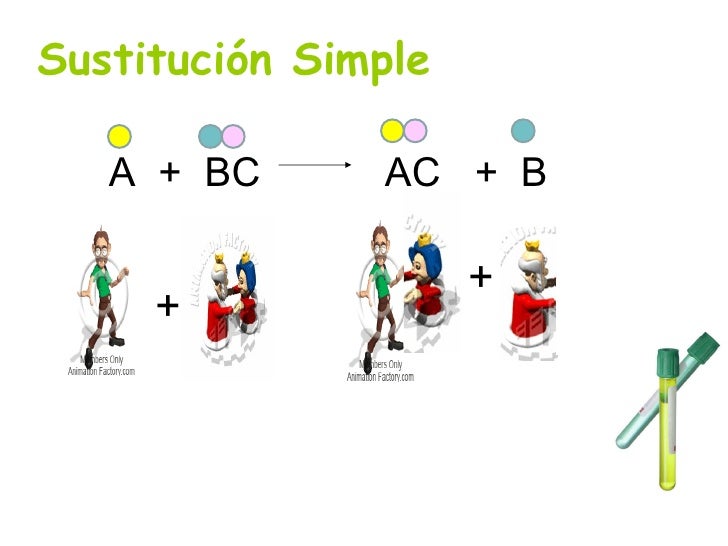
Reacción de sustitución simple
En general se presenta cuando un elemento químico mas activo o mas reactivo desplaza a otro elemento menos reactivo que se encuentra formando parte de un compuesto; el elemento que a sido desplazado queda en forma libre.
En el caso de los metales, los mas activos son los metales alcalinos y metales alcalinos térreos.
En el caso de los no metales, los mas reactivos son algunos halogenos : Fl2 , Cl2 , Br2 ; además del oxígeno y el fósforo.
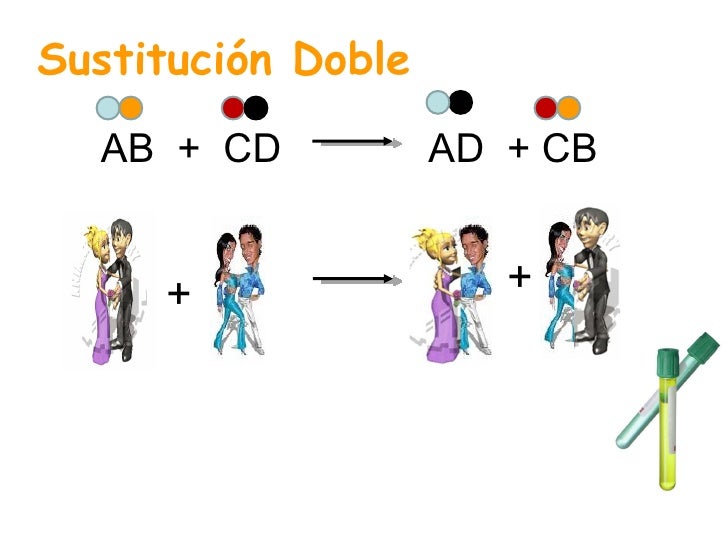
Reacción de doble sustitución
Las Reacciones de Doble Sustitución, de Doble Desplazamiento o de Metástasis, son aquellas en las que dos elementos que se encuentran en compuestos diferentes intercambian sus posiciones formando dos nuevos compuestos según la siguiente fórmula:AB + CD → CB + AD
donde los elementos A y C intercambian posiciones.
Nota: estas reacciones no experimentan cambios en los números de oxidación de los elementos por lo que no son Reacciones Redox.
reacción de combustión
Desde el punto de vista de la teoría clásica, la combustión se refiere a las reacciones de oxidación, que se producen de forma rápida, de materiales llamados combustibles, formados fundamentalmente por carbono (C) e hidrógeno (H) y en algunos casos por azufre (S), en presencia de oxígeno, denominado el comburente y con gran desprendimiento de calor.
Desde un punto de vista funcional, la combustión es el conjunto de procesos físico-químicos, por los cuales se libera controladamente parte de la energía interna del combustible (energía química) que se manifiesta al exterior bajo la forma de calor, para ser aprovechado dentro de un horno o una caldera.3
Desde un punto de vista funcional, la combustión es el conjunto de procesos físico-químicos, por los cuales se libera controladamente parte de la energía interna del combustible (energía química) que se manifiesta al exterior bajo la forma de calor, para ser aprovechado dentro de un horno o una caldera.3
reacción de neutralizacion
Una reacción de
neutralización es aquélla en la cual reacciona un ácido (o un óxido ácido) con
una base (u óxido básico). En la reacción se forma una sal y en la mayoría de
casos se forma agua. El único caso en el cual no se forma agua es en la combinación
de un óxido de un no metal con un óxido de un metal.
Esta reacción también se puede considerar como una
reacción de doble desplazamiento en la que el ion hidrógeno del ácido se
combina con el ion hidroxilo de la base para formar agua. Esto deja al ion
sodio y al ion cloruro en la solución, la cual es una solución acuosa de
cloruro de sodio.
Considere los siguientes ejemplos de varios tipos
de reacciones de neutralización:
Acido + base sal + agua
Oxido
de metal + óxido de no metal sal
Como se indicó
anteriormente en la unidad de reacciones de combinación, estas reacciones se
pueden considerar como reacciones de neutralización. Puesto que el óxido del
metal es un anhídrido básico y el óxido de un no metal es un anhídrido ácido,
la combinación de éstos para formar la sal es realmente un tipo de reacción
ácido-base.
quimicas (2015) Ejemplos de reacciones de combinacion. recuperado de http://www.quimicas.net/2015/05/ejemplos-de-reacciones-de-combinacion.html


gracias.
ResponderEliminar